Anak IPA? Persiapkan Dirimu dengan Latihan Soal UN Kimia SMA
Squad, apakah kamu anak IPA? Sudah sampai mana persiapanmu dalam menghadapi UN mendatang? Tidak sampai empat bulan lagi UN 2019 akan berlangsung, lho. Yuk, gunakan waktumu sebaik-baiknya dengan berlatih soal UN Kimia SMA beserta pembahasannya berikut ini.
-23.png)
1. Topik : Perkembangan teori atom
Berdasarkan percobaan hamburan sinar alfa yang dilakukan oleh Rutherford dinyatakan bahwa sebagian besar volume atom adalah ruangan kosong. Kesimpulan tersebut diperoleh berdasarkan fakta bahwa….
- sebagian besar sinar diteruskan
- terdapat sinar yang dipantulkan
- sebagian kecil sinar dibelokkan
- sebagian besar sinar dihamburkan
- terdapat sinar yang diserap
Jawaban : A
Pembahasan :
Hasil yang diperoleh dari percobaan penembakan sinar alfa terhadap lempengan emas oleh E. Rutherford adalah:
- Atom bukan merupakan bola pejal, karena sebagian besar sinar diteruskan sehingga diketahui bahwa sebagian besar volume atom merupakan ruang kosong.
- Partikel alfa yang bermuatan positif dipantulkan kembali karena tepat menabrak inti atom yang juga bermuatan positif
-23.png)
2. Topik : Kimia Dasar
Di bawah ini terdapat konfigurasi elektron beberapa unsur.
R = [Ar] 4s2 3d5
S = [Ar] 4s2 3d10 4p2
T = [Ne] 3s2 3p2
U = [Ne] 3s2 3p5
V = [Ne] 3s2 3p3
Unsur-unsur yang memiliki kemiripan sifat adalah….
- R dan S
- S dan U
- S dan T
- U dan V
- T dan V
Jawaban : C
Pembahasan : Unsur – unsur yang memiliki kemiripan sifat berada dalam satu golongan yang sama. Letak golongan dalam unsur dapat dilihat dari konfirgurasi elektron dengan melihat elektron valensinya.
R = [Ar] 4s2 3d5 ->golongan VIIB, periode 4
S = [Ar] 4s2 3d10 4p2 golongan IVA, periode 4
T = [Ne] 3s2 3p2 golongan IVA, periode 4
U = [Ne] 3s2 3p5 golongan VIIA, periode 4
V = [Ne] 3s2 3p3 golongan VA, periode 4
Sehingga unsur yang memiliki kemiripan sifat adalah unsur S dan T.
-23.png)
3. Topik : Hubungan konfigurasi elektron dengan ikatan
Unsur P memiliki nomor atom 12 dan unsur Q memiliki nomor atom 35. Jika kedua unsur tersebut berikatan, maka rumus senyawa dan ikatan yang terbentuk adalah….
- PQ2, ikatan ion
- PQ2, ikatan kovalen
- P2Q, ikatan ion
- PQ, ikatan ion
- PQ, ikatan kovalen
Jawaban : A
Pembahasan:
12P = 2, 8, 2 (cenderung melepas 2 elektron untuk mencapai kestabilan oktet → ion +2)
35Q = 2, 8, 18, 7 (cenderung menangkap 1 elektron untuk mencapai kestabilan oktet → ion –1)
Berdasarkan data di atas, maka unsur P dapat berikatan dengan 2 unsur Q untuk membentuk senyawa netral.
P2++2Q- PQ2
Jenis ikatan antara P dan Q adalah ikatan ion karena terbentuk dari interaksi elektrostatik ion P (bermuatan positif) dan ion Q (bermuatan negatif).
-23.png)
4. Topik : Teori Hibridisasi
Perhatikan konfigurasi elektron berikut!
P : 1s2 2s2 2p2
Q : 1s2 2s2 2p6 3s2 3p5
Jika P dan Q membentuk senyawa PQ4, bentuk molekulnya adalah….
- tetrahedron
- segitiga piramida
- bengkok
- bentuk T
- segiempat datar
Jawaban : A
Pembahasan:
P : 1s2 2s2 2p2
Q : 1s2 2s2 2p6 3s2 3p5
Senyawa PQ4 memiliki atom P sebagai atom pusatnya, sehingga atom P harus menyediakan elektron tak berpasangan untuk berikatan dengan atom Q.
Hibridisasi senyawa PQ4 yaitu :
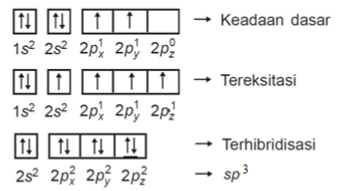
Senyawa PQ4 memiliki hibridisasi sp3, maka bentuk molekulnya adalah tetrahedral.
-23.png)
6. Topik : Trayek pH
Perhatikan data uji pH dua buah air limbah berikut!
Dari hasil pengujian maka pH air limbah 1 dan limbah 2 berturut – turut adalah….
- pH ≤ 8,3 dan pH ≥ 10
- pH ≤ 4,2 dan pH ≥ 10
- 4,2 ≤ pH ≤ 8,3 dan pH ≥ 10
- 4,2 ≤ pH ≤ 6,0 dan 7,6 ≤ pH ≤ 10
- 4,2 ≤ pH ≤ 8,3 dan pH ≤ 10
Jawaban : D
Pembahasan :
Limbah 1 :
- Hasil uji metil merah menunjukkan warna merah, artinya memiliki pH ≤ 4,2.
- Hasil uji bromtimol biru menunjukkan warna kuning, artinya memiliki pH ≤ 6,0.
- Hasil uji fenolftalein menunjukkan tak berwarna, artinya memiliki pH ≤ 8,3.
Limbah 2 :
- Hasil uji metil merah menunjukkan warna kuning, artinya memiliki pH ≥ 6,3.
- Hasil uji bromtimol biru menunjukkan warna biru, artinya memiliki pH ≥ 7,6.
- Hasil uji fenolftalein menunjukkan merah, artinya memiliki pH ≥ 10.
Range pH untuk limbah 1 adalah 4,2 ≤ pH ≤ 6,0.
Range pH untuk limbah 2 adalah 7,6 ≤ pH ≤ 10,0.
-23.png)
6. Topik : Menghitung pH
Asam lemah H2S dengan konsentrasi 0.01M mengion menurut reaksi berikut:
H2S ⇋ H+ + HS– Ka1 : 9.0 x 10-8
HS– ⇋ H+ + S2- Ka2 : 1.2 x 10-15
pH asam sulfida tersebut adalah….
- 4 – log 3
- 5 – log 3
- 5 – log 9
- 6 – log 3
- 8 – log 9
Jawaban :B
Pembahasan :
Asam sulfida merupakan contoh asam lemah. H2S mengalami dua kali reaksi ionisasi karena memiliki jumlah H+ sebanyak 2 buah. Untuk mencari [H+] asam lemah, dapat digunakan rumus berikut :
[H+]1 = Ka1 x M
= 9 x 10-8x 10-2
= 9 x 10-10
= 3 x 10-5
[H+]2 = Ka2 x M
= 1,2 x 10-15x 10-2
= 12 x 10-18
= 3,46 x 10-9
Karena nilai [H+]1 >>> [H+]2, maka [H+]2 dapat diabaikan. Untuk mencari pH dapat digunakan [H+]1.
pH = –log [H+]
= –log 3 x 10-5
= 5 – log 3
-23.png)
7. Topik : Titrasi berdasarkan grafik
Perhatikan grafik titrasi di bawah ini!
Dari grafik di atas maka dapat disimpulkan bahwa titrasi tersebut merupakan titrasi antara… dengan indikator…
- asam kuat – basa kuat, phenolphtalein
- asam kuat – basa kuat, metil orange
- basa kuat – asam kuat, metil jingga
- asam lemah – basa kuat, phenolphtalein
- asam lemah – basa kuat, metil orange
Jawaban : A
Pembahasan :
Jika dilihat dari grafik di atas, titrasi diawali dari nilai pH yang mendekati 0, maka dapat disimpulkan bahwa grafik tersebut merupakan titrasi asam kuat oleh basa kuat karena titik akhir titrasi mendekati nilai pH 14. Indikator yang cocok untuk titrasi antara asam kuat dan basa kuat adalah phenolphtalein.
-23.png)
8. Topik : Larutan penyangga dalam tubuh
Darah manusia merupakan salah satu sistem larutan penyangga. Proses metabolisme manusia kebanyakan membebaskan asam seperti asam laktat, asam fosfat dan lainnya. Reaksi larutan penyangga dalam darah untuk mempertahankan pH dari kelebihan asam adalah….
- HPO42- + H+ → H2PO4–
- H2PO4– + H+ → H3PO4
- H2CO3 + OH– → HCO3– + H2O
- HCO3– + H+ → H2CO3
- CO32- + H+ → HCO3–
Jawaban : D
Pembahasan :
Apabila suatu sistem penyangga akan mempertahankan pH akibat penambahan asam, maka asam tersebut (H+) akan bereaksi dengan basa konjugasi penyangganya.
Sistem penyangga dalam darah (intraseluler) adalah asam karbonat – bikarbonat. Sistem ini jika bereaksi dengan asam akan menghasilkan reaksi sebagai berikut :
HCO3– + H+ → H2CO3
-23.png)
9. Topik : Mengidentifikasi jenis garam hidrolisis
Perhatikan garam – garam berikut!
- NH4Cl
- CH3COONa
- (NH4)2SO4
- KCN
Garam yang bersifat asam ketika dilarutkan ke dalam air adalah….
- 1 dan 2
- 1 dan 3
- 1 dan 4
- 2 dan 3
- 2 dan 4
Jawaban : B
Pembahasan :
Garam yang bersifat asam ketika dilarutkan ke dalam air adalah garam yang terdiri dari asam kuat dan basa lemah, dimana garam ini menghasilkan ion H+ di dalam air.
- NH4Cl + H2O → NH4OH + H+ + Cl– (asam)
- CH3COONa + H2O → CH3COOH + Na+ + OH– (basa)
- (NH4)2SO4 + 2H2O → 2NH4OH + 2H+ +SO42- (asam)
- KCN + H2O → K+ + OH– + HCN (basa)
-23.png)
10. Topik : Memprediksi endapan (Ksp)
Jika Diketahui Ksp AgCl = 1.0 x 10-10, maka pencampuran 100 mL larutan AgNO3 0.01M dengan 100 ml larutan NaCl 0.001M akan menghasilkan….
- endapan AgCl
- endapan AgNO3
- endapan NaCl
- tidak terbentuk endapan
- larutan tepat jenuh
Jawaban : A
Pembahasan :
Reaksi yang terjadi adalah :
AgNO3(aq)+NaCl(aq)⟶AgCl(s)+ NaNO3(aq)
AgCl(s)⇌ Ag+(aq)+Cl-(aq)
Qsp = [Ag+][Cl-]
Qsp =0,01 M x 100 ml200 ml0,001 M x 100 ml200 ml
Qsp= 2,5 x 10-6
Karena Qsp > Ksp, maka terbentuk endapan AgCl.
-23.png)
11. Topik : perubahan entalpi
Jika diketahui data – data sebagai berikut:
∆Hfo C3H8(g) = + 227kJ/mol
∆Hfo CO2(g) = – 393kJ/mol
∆Hfo. H2O(l) = – 285kJ/mol
maka nilai perubahan entalpi pembakaran propana adalah….
- – 2546 kJ/mol
- −905 kJ/mol
- +905 kJ/mol
- +1298 kJ/mol
- +2546 kJ/mol
Jawaban : A
Pembahasan :
Reaksi pembakaran propana adalah sebagai berikut :
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l)
Penentuan nilai ∆H reaksi menggunakan data ∆Hfo adalah sebagai berikut :
∆H= ∆Hfo(produk-reaktan)
∆H=3x∆HfoCO2+4x∆HfoH2O-(∆HfoC3H8+5x∆HfoO2)
∆H=(3x-393)+(4x-285)-((227)+(5×0))
∆H=-1179-1140-(227)
∆H=-1179-1140-(227)
∆H=-2319-(227)
∆H=-2546 kJ/mol
-23.png)
12. Topik : Energi ikatan
Diketahui nilai energi ikatan Cl2 (g) dan Br2 (g) berturut-turut adalah 243kJ/mol dan 190kJ/mol, serta energi ikatan rata-rata H – Cl dan H – Br berturut-turut adalah 432kJ/mol dan 370kJ/mol. Nilai perubahan entalpi pada reaksi di bawah ini adalah …
2HBr (g) + Cl2 → 2HCl(g) + Br2(g)
- – 71 kJ/mol
- – 35,5 kJ/mol
- +35,5 kJ/mol
- +71 kJ/mol
- +142 kJ/mol
Jawaban : A
Pembahasan :
2HBr (g) + Cl2 → 2HCl(g) + Br2(g)
Penentuan nilai perubahan entalpi menggunakan data energi ikatan adalah sebagai berikut :
∆H = ∑ energi ikatan kiri – ∑ energi ikatan kanan
∆H =2 H-Br+Cl-Cl-[2H-Cl+Br-Br]
∆H =[2 (370kJ/mol) + 243 kJ/mol] – [2(432kJ/mol) + 190kJ/mol]
∆H= [983 kJ/mol] – [1054kJ/mol]
∆H= -71 kJ/mol
-23.png)
13. Topik : Kc atau Kp
Nilai Kp reaksi kesetimbangan berikut adalah 2,46 :
2NH3(g) ⇌ N2(g) + 3H2(g)
Harga Kc reaksi tersebut pada suhu 27 oC adalah….
- 2.46 x (0.082 x 300)1
- 2.46 x (0.082 x 300)2
- 2.46(0.082 x 300)2
- 2.46(0.082 x 300)
- (0.082 x 300)22.46
Jawaban : C
Pembahasan :
Hubungan Kc dan Kp dari reaksi kesetimbangan dinyatakan dengan persamaan berikut:
Kp = Kc(RT)∆n
∆n = koefisien produk – koefisien reaktan = 4 – 2 = 2
T = suhu = 27oC + 273 = 300K
R adalah tetapan = 0,082
sehingga diperoleh :
2,46=Kc(0,082 x 300)2
Kc= 2,46(0,082 x 300)2
-23.png)
14. Topik : hukum faraday
Massa logam perak yang diendapkan di katode pada reaksi elektrolisis larutan AgNO3 menggunakan arus listrik sebesar 2A selama 10 menit adalah…. (Ar Ag = 108)
- (96.500 x 108 x 200) gram
- (108/96.500) x 200 gram
- 96.500 x 20 gram
- (108/96.500) x 1200 gram
- (96.500 x 108 x 200 gram
Jawaban: D
Pembahasan :
Massa logam yang terendapkan dari proses elektrolisis dapat dicari menggunakan hukum Faraday I sebagai berikut :
w= e x i x t96500= Arbiloksx i x t96500
w=1081 x 2 x 60096500
w= 10896500×1200 gram
-23.png)
15. Topik : Kespontanan reaksi
Diketahui data potensial reduksi sebagai berikut:
E0 Ca2+/Ca = – 2.87V
E0 Pb2+/Pb = -0.13V
E0 Mg2+/Mg = -2.37V
E0 Au3+/Au = +1.5 V
Reaksi yang dapat berlangsung adalah….
- Mg + Ca2+ → Mg2+ + Ca
- Ca + Mg → Ca2+ + Mg2+
- Pb + Mg2+ → Pb2+ + Mg
- Mg + Pb2+ → Mg2+ + Pb
- Pb2+ + Au3+ → Pb + Au
Jawaban : D
Pembahasan :
Reaksi yang dapat berlangsung (spontan) ditandai dengan potensial reaksi (E0sel) yang bernilai positif (> 0)
Untuk reaksi pada jawaban (b) dan (e) bukan merupakan reaksi redoks, sehingga tidak perlu dihitung.
E0sel = E0red – E0oks
Pada pilihan A : E0sel = (E0 Ca2+/Ca) – (E0 Mg2+/Mg)
E0sel = – 2.87V – (-2.37V) = – 0.5V
Pada pilihan C : E0sel = (E0 Mg2+/Mg) – (E0 Pb2+/Pb)
E0sel = – 2.37V – (-0.13V) = – 2.24V
Pada pilihan D : E0sel = (E0 Pb2+/Pb) – (E0 Mg2+/Mg)
E0sel = -0.13V – (-2.37V) = +2.24V
Maka, reaksi yang dapat berlangsung adalah Mg + Pb2+ → Mg2+ + Pb
Karena nilai E0sel > 0
-23.png)
16. Topik: Pembentukan minyak bumi
Minyak bumi terbentuk akibat adanya aktivitas biokimia bakteri yang mengubah unsur – unsur tertentu menjadi zat yang mengandung hidrokarbon. Teori tersebut merupakan teori….
- organik
- anorganik
- biogenetik
- dupleks
- dekomposisi
Jawaban : B
Pembahasan :
Teori pembentukan minyak bumi terdiri dari :
-
teori organik atau biogenesis menyatakan bahwa minyak bumi terbentuk karena adanya kebocoran kecil yang permanen dalam siklus karbon
-
teori anorganik atau abiogenesis menyatakan bahwa minyak bumi terbentuk dari adanya aktivitas biokimia bakteri yang mengubah unsur – unsur tertentu menjadi senyawa yang mengandung hidrokarbon
-23.png)
17. Topik : Gas polutan
Gas hasil pembakaran bahan bakar yang tidak sempurna dapat mengganggu pengikatan oksigen oleh hemoglobin dalam darah. Gas hasil pembakaran tersebut adalah….
- karbon dioksida
- karbon monoksida
- oksida belerang
- nitrogen oksida
- PbBr2
Jawaban : B
Pembahasan :
Hasil pembakaran bahan bakar yang tidak sempurna akan menghasilkan gas karbon monoksida (CO).
Karbon monoksida dapat mengganggu pengikatan oksigen oleh hemoglobin karena hemoglobin akan cenderung mengikat CO dibandingkan dengan oksigen. Hal tersebut akan meningkatkan toksisitas dalam tubuh dan jaringan tubuh akan kekurangan oksigen sehingga tidak dapat menghasilkan ATP atau energi. Jumlah paparan CO yang berlebihan dapat menyebabkan berkurangnya kesadaran hingga kematian.
-23.png)
18. Topik : Reaksi hidrokarbon
Reaksi pembakaran sempurna hidrokarbon dengan oksigen akan menghasilkan senyawa….
- CO dan air
- Air dan H2
- CO2 dan H2
- Karbon dan air
- CO2 dan H2O
Jawaban : E
Pembahasan:
Reaksi pembakaran senyawa hidrokarbon sempurna dengan oksigen menghasilkan CO2 dan air menurut persamaan reaksi berikut:
CxHy + O2 → CO2 + H2O
Sedangkan reaksi pembakaran senyawa hidrokarbon tidak sempurna dengan oksigen menghasilkan jelaga C, CO dan air.
CxHy + O2 → C(s) + CO + H2O
-23.png)
19. Topik : Turunan benzena
Perhatikan struktur turunan senyawa benzena berikut ini!
Senyawa turunan benzena di atas dinamakan….
- fenol
- toluena
- anilina
- anisol
- stirena
Jawaban : C
Pembahasan :
Senyawa turunan benzena yang berikatan dengan satu substituen, secara IUPAC diberi nama dengan aturan : nama substituen + benzena
NH2 merupakan gugus amin, maka nama IUPAC senyawa ini adalah : aminobenzena
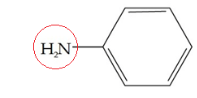
Nama trivialnya : anilina
Jika benzena berikatan dengan – OH dinamakan hidroksibenzena (fenol).
Jika benzena berikatan dengan – CH3 dinamakan metilbenzena (toluena).
Jika benzena berikatan dengan – OCH3 dinamakan metoksibenzena (anisol).
Jika benzena berikatan dengan CH = CH2 dinamakan vinilbenzena (stirena).
-23.png)
20. Topik : Sifat asam basa
Teori asam basa Arrhenius mengatakan bahwa basa adalah….
- spesi yang menghasilkan OH– dalam air
- spesi yang menghasilkan H+ dalam air
- spesi yang mendonorkan proton
- sepsi yang menerima proton
- spesi yang menggunakan pasangan elektron bersama
Jawaban : A
Pembahasan :
Arhennius menyatakan bahwa :
- Asam adalah senyawa/spesi yang menghasilkan ion H+ di dalam air.
- Basa adalah senyawa/spesi yang menghasilkan ion OH– di dalam air.
-23.png)
Psst, sehabis Kimia, masih ada mata pelajaran UN lainnya lho yang akan dibahas di blog Ruangguru. Jangan sampai ketinggalan dan tungguin terus ya. Yuk, perkaya juga pemahaman kamu dengan video beranimasi, latihan soal, dan rangkuman infografis di ruangbelajar.