Mengenal Sel Volta Penghasil Energi Listrik | Kimia Kelas 12
Hai RG Squad, kalian tahu nggak kalau sel elektrokimia itu terdiri dari sepasang elektroda. Elektroda itu sebelumnya dicelupkan ke dalam suatu lelehan atau larutan ion, kemudian dihubungkan dengan penghantar logam pada rangkaian luar. Nah, sel elektrokimia dapat berupa sel volta atau sel galvani, dan sel elektrolisis. Pada artikel ini kita akan bahas tentang mengenal sel volta, kalian sudah tahu belum? Jika belum dan ingin mengetahui seperti apa sel volta itu, simak baik-baik penjelasannya ya.
Sel volta adalah sel elektrokimia yang dapat menghasilkan energi listrik, hal itu disebabkan oleh terjadinya reaksi redoks yang spontan. Sel volta sering juga disebut sebagai sel Galvani, kenapa? Karena Volta dan Galvani adalah ahli yang menemukan fenomena sel elektrokimia. Luigi Galvani (1737-1798), merupakan ahli fisiologi berkebangsaan Italia yang menyatakan adanya sifat listrik pada tulang hewan, ia membuktikannya melalui percobaannya pada tulang katak. Sementara Alessandro Volta (1745-1827), ahli fisika yang juga berkebangsaan Italia, melakukan percobaan yang sama dan menyatakan bahwa aliran listrik yang terjadi adalah karena kontak logam yang tidak sama.
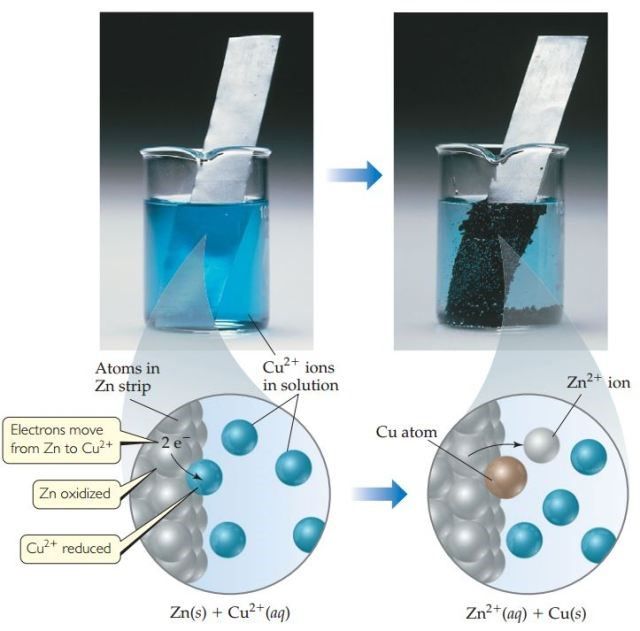
Reaksi redoks yang spontan, reaksi logam seng (Zn, Zinc) dengan larutan tembaga (II) sulfat (sumber ion Cu, atau copper)
Jika RG Squad ingin lebih memahami sel volta, yang harus dipahami terlebih dahulu adalah reaksi redoks spontan. Salah satu contoh reaksi redoks spontan adalah reaksi logam seng dengan larutan tembaga (II) sulfat. Jika logam seng yang berwarna abu-abu mengkilat dicelupkan ke dalam larutan tembaga (II) sulfat yang berwarna biru, lambat laun pada permukaan logam seng akan menempel logam tembaga yang berwana merah kecoklatan, sementara warna biru dari larutan akan memudar. Tembaga yang menempel pada logam seng berasal dari larutannya (ion tembaga (II) yang memberikan warna biru dalam pelarut air). Sementara itu, logam seng membentuk ionnnya yang larut dalam air, tetapi tidak memberikan warna pada larutannya. Reaksi tersebut dapat dinyatakan dengan persamaan:
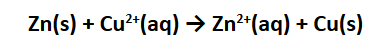 Dalam persamaan reaksi diatas, kita bisa lihat bahwa logam seng mengalami oksidasi membentuk ion seng (II). Reaksi ini disertai dengan pelepasan elektron:
Dalam persamaan reaksi diatas, kita bisa lihat bahwa logam seng mengalami oksidasi membentuk ion seng (II). Reaksi ini disertai dengan pelepasan elektron:
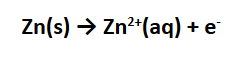 Ion tembaga (II) membentuk logamnya dengan menerima elektron:
Ion tembaga (II) membentuk logamnya dengan menerima elektron:
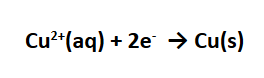 Jika reaksi dilangsungkan dengan cara di atas, elektron yang dilepaskan dari reaksi oksidasi langsung digunakan untuk reaksi reduksi pada permukaan logam seng. Elektron tidak berkesempatan untuk menghasilkan arus listrik yang dapat menghasilkan kerja.
Jika reaksi dilangsungkan dengan cara di atas, elektron yang dilepaskan dari reaksi oksidasi langsung digunakan untuk reaksi reduksi pada permukaan logam seng. Elektron tidak berkesempatan untuk menghasilkan arus listrik yang dapat menghasilkan kerja.

Jadi, sel volta merupakan sel elektrokimia yang menghasilkan energi listrik. Nah, sel volta lahir atas pemikiran Alessandro Volta setelah ia merespon pemikiran Luigi Galvani, dan menganggap pemikiran Galvani itu salah. Sel volta juga memiliki rangkaian, kalian bisa membacanya pada artikel Rangkaian Sel Volta.
Mau belajar materi Kimia lainnya dengan metode seru dan nggak ngebosenin? Yuk, kita belajar di ruangbelajar.




















