Latihan Soal & Pembahasan UTBK 2022: Kimia
Sudah siap hadapi UTBK tahun 2022 nanti? Yuk, tingkatkan persiapanmu dengan latihan soal UTBK 2022 Kimia beserta pembahasannya di bawah ini. Selamat mengerjakan!
—

Topik : Struktur Atom dan Sistem Periodik Unsur
Subtopik : Konsep Kilat Sifat Keperiodikan Unsur
Perhatikan tabel SPU berikut!

1. Pernyataan yang tepat untuk sifat keperiodikan kelima unsur tersebut adalah …
- Jari-jari atom unsur A lebih kecil daripada unsur C.
- Energi ionisasi unsur B lebih besar daripada unsur C.
- Unsur A memiliki keelektronegatifan terbesar.
- Afinitas elektron unsur A lebih besar dari unsur C.
- Unsur B memiliki jari-jari atom paling besar.
Kunci Jawaban : B
Pembahasan :
Sifat-sifat keperiodikan unsur, yaitu sebagai berikut.
- Jari-jari atom adalah jarak dari inti atom ke kulit terluar yang ditempati elektron. Dalam satu golongan dari atas ke bawah, jari-jari atom cenderung makin besar, sedangkan dalam satu periode dari kiri ke kanan, cenderung makin kecil. Jari-jari atom unsur A lebih besar daripada unsur C. Unsur yang memiliki jari-jari atom terbesar adalah unsur E. (Opsi A dan E salah)
- Energi ionisasi adalah energi minimum yang diperlukan atom dalam keadaan gas untuk melepaskan elektron pada kulit terluarnya. Dalam satu golongan dari atas ke bawah, energi ionisasi cenderung makin kecil, sedangkan dalam satu periode dari kiri ke kanan cenderung makin besar. Oleh karena itu, energi ionisasi unsur B lebih besar daripada unsur C. (Opsi B benar)
- Keelektronegatifan adalah kecenderungan suatu atom untuk menarik elektron dari atom lain dalam suatu ikatan kimia. Dalam satu golongan dari atas ke bawah, keelektronegatifan cenderung makin kecil, sedangkan dalam satu periode dari kiri ke kanan cenderung makin besar. Unsur yang memiliki keelektronegatifan terbesar adalah unsur B. (Opsi C salah)
- Afinitas elektron adalah besarnya energi yang dihasilkan atau dibebaskan oleh atom dalam keadaan gas untuk menangkap satu elektron. Dalam satu golongan dari atas ke bawah, afinitas elektron cenderung makin kecil, sedangkan dalam satu periode dari kiri ke kanan cenderung makin besar. Afinitas elektron unsur A lebih kecil dari unsur C. (Opsi D salah)
Jawaban yang tepat adalah B.

Topik : Ikatan Kimia, Bentuk Molekul, dan Gaya Antarmolekul
Subtopik : Konsep Kilat Ikatan Kimia dan Bentuk Molekul
Diketahui data unsur sebagai berikut.
Unsur X : golongan IIA dan periode 3
Unsur Y : golongan VIA dan periode 2
2. Jika X dan Y berikatan, ikatan yang mungkin terjadi dan senyawa yang terbentuk secara berurutan adalah ….
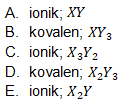
Kunci Jawaban : A
Pembahasan :
Unsur X : golongan IIA elektron valensi = 2. Unsur X stabil dengan melepas 2 elektron membentuk ![]() .
.
Unsur Y : golongan VIA elektron valensi = 6. Unsur Y stabil dengan menangkap 2 elektron membentuk ![]() .
.
Senyawa yang terbentuk : 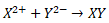
Ikatan yang terbentuk merupakan ikatan ionik karena terjadi serah terima elektron.
Jadi, jawaban yang tepat adalah A.

Topik : Kimia Karbon
Subtopik : Konsep Kilat Senyawa Turunan Alkana
3. Seorang laboran akan membuat larutan dengan cara mencampurkan larutan X dengan larutan NaOH dalam gelas kimia. Volume dan konsentrasi dari masing-masing reaktan adalah sama, yaitu 100 mL dan 0,3 M. Diketahui bahwa larutan X diperoleh dari oksidasi larutan Y yang memberikan hasil positif dengan pereaksi Tollens. Kemungkinan larutan X yang digunakan oleh laboran tersebut adalah ….
- 1-propanol
- Propanal
- 2-propanon
- asam propanoat
- metil asetat
Jawaban: D
Pembahasan:
Pereaksi Tollens digunakan untuk mengidentifikasi senyawa aldehid dan keton. Reaksi oksidasi aldehid dengan pereaksi Tollens akan memberikan hasil positif (terbentuk endapan perak), sedangkan senyawa keton memberikan hasil negatif (tidak terbentuk endapan perak).
Larutan Y memberikan hasil positif dengan pereaksi Tollens dan ketika dioksidasi menghasilkan larutan X, artinya Y merupakan senyawa aldehid. Hasil oksidasi aldehid adalah senyawa yang memiliki gugus karboksil atau asam karboksilat. Oleh karena itu, X merupakan senyawa asam karboksilat.
Jenis senyawa pada opsi jawaban adalah sebagai berikut.
- 1-propanol
 alkohol primer
alkohol primer - propanal
 aldehid
aldehid - 2-propanon
 keton
keton - asam propanoat
 asam karboksilat
asam karboksilat - metil asetat
 ester
ester
Dengan demikian, kemungkinan larutan X yang digunakan oleh laboran tersebut adalah asam propanoat.
Jadi, jawaban yang benar adalah D.

Topik : Stoikiometri
Subtopik : Konsep Kilat Stoikiometri Reaksi dan Kadar
4. Di dalam laboratorium, suatu sampel urin yang mengandung 1,5 gram urea direaksikan dengan asam nitrit berlebih. Urea bereaksi menurut persamaan berikut.
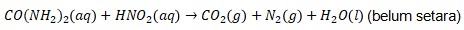
Gas yang dihasilkan lalu dialirkan melalui larutan NaOH dan volume akhir diukur. Volume gas yang telah melewati larutan NaOH pada temperatur dan tekanan ruang adalah ….
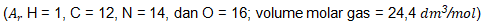
Kunci Jawaban : E
Pembahasan :
Pertama, setarakan persamaan reaksinya terlebih dahulu.
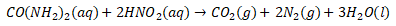
Lalu, hitung mol urea menggunakan persamaan berikut.
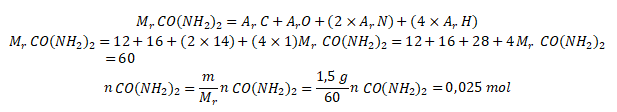
Kemudian, hitung mol gas karbon dioksida dan gas nitrogen menggunakan perbandingan koefisien sebagai berikut.
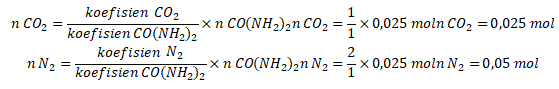
Dari reaksi tersebut, terdapat 2 jenis gas, yaitu 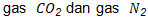 . Pengukuran sampel dilakukan pada temperatur dan tekanan ruang, yaitu pada suhu 25 derajat dan tekanan 1 atm. Dengan demikian, volume
. Pengukuran sampel dilakukan pada temperatur dan tekanan ruang, yaitu pada suhu 25 derajat dan tekanan 1 atm. Dengan demikian, volume 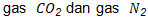 yang dihasilkan dapat dihitung sebagai berikut.
yang dihasilkan dapat dihitung sebagai berikut.
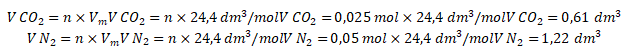
Ingat! Gas ![]() adalah gas asam sehingga akan bereaksi ketika dilarutkan ke dalam NaOH. Dengan demikian, volume gas yang telah melewati larutan NaOH (volume gas
adalah gas asam sehingga akan bereaksi ketika dilarutkan ke dalam NaOH. Dengan demikian, volume gas yang telah melewati larutan NaOH (volume gas ![]() ) pada kondisi yang ditentukan pada soal adalah
) pada kondisi yang ditentukan pada soal adalah 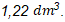 .
.
Jadi, jawaban yang tepat adalah E.

Topik : Sifat Koligatif Larutan
Subtopik : Konsep Kilat Sifat Koligatif Larutan
5. Dalam dunia kedokteran, tekanan osmotik perlu diperhatikan dalam proses pemberian infus kepada pasien. Tekanan osmotik dalam darah berkisar 7,7 atm pada suhu darah 38 derajat celcius. Apabila seseorang memerlukan injeksi cairan nutrisi/infus, tekanan osmotik cairan infus tersebut harus isotonik dengan tekanan osmotik darah. Jumlah NaCl yang diperlukan untuk membuat larutan infus sebanyak 1000 mL yang dibutuhkan oleh pasien tersebut adalah …. 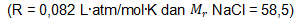
- 8,8 g
- 5,5 g
- 4,4 g
- 4,0 g
- 3,0 g
Jawaban: A
Pembahasan:
Isotonik artinya memiliki tekanan osmotik yang sama.
Diketahui:
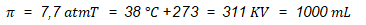
Ditanyakan:
Massa NaCl yang dilarutkan
Pembahasan:
NaCl merupakan garam yang bersifat elektrolit kuat, artinya dapat terurai menjadi ion-ionnya.
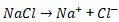
Jumlah ion (n) = 2
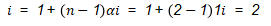
Massa NaCl yang diperlukan untuk membuat larutan infus tersebut dapat ditentukan melalui persamaan berikut.
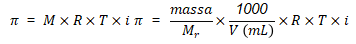
Berdasarkan persamaan di atas, massa dapat ditentukan sebagai berikut.
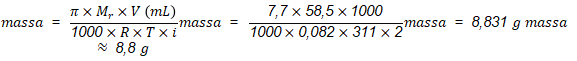
Jadi, jawaban yang tepat adalah A.

Topik : Ikatan Kimia dan Bentuk Molekul
Subtopik : Bentuk dan Geometri Molekul
6. Unsur Xe merupakan golongan gas mulia yang sukar berikatan dengan unsur lain. Namun, seiring berkembangnya teknologi, ternyata dapat dibuat senyawa dari unsur Xe dengan unsur paling elektronegatif F yaitu XeF4. Geometri dan tipe hibridisasi pada molekul XeF4 (NA Xe = 54, F = 9) adalah…
- segi empat planar, sp3d2
- tetrahedron, sp3d
- segi empat planar, sp2d
- tetrahedron, sp3
- bipiramida trigonal, sp3
Kunci : A
Pembahasan :
Untuk membuat hibridisasi yang dilihat adalah atom pusat. Pada senyawa XeF4 yang menjadi atom pusat adalah Xe. Konfigurasi elektron 54Xe = [Kr] 5s24d10 5p6
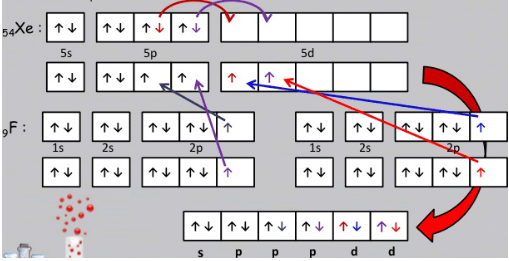

Topik : Redoks dan Elektrokimia
Subtopik : Sel Volta; Hukum Faraday
7. Suatu sel elektrokimia dengan elektroda Zn dan Ag pada keadaan standar menghasilkan arus 0,75 A selama 321 menit. Diketahui nilai:
E0 Zn2+ | Zn = -0,76 V
E0 Ag+ | Ag = +0,8 V
maka pengurangan massa dianoda adalah … gram. (F = 96.500 C, Ar Zn = 65, Ag = 108)
- 3,250
- 4,865
- 6,321
- 10,850
- 13,106
Kunci : B
Pembahasan :
Pada katoda terjadi reaksi reduksi, sedangkan anoda oksidasi. Potensial reduksi Ag lebih besar dari Zn, sehingga pengurangan massa di anoda terjadi dari oksidasi Zn.
Katoda: Ag+ + e– → Ag
Anoda: Zn → Zn2+ + 2e–
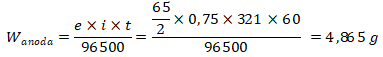

Topik : Laju Reaksi
Subtopik : Persamaan Laju Reaksi dan Konstanta Laju Reaksi Multi Experiment
8. Percobaan penentuan laju reaksi:
2H2(g) + 2NO(g) ![]() 2H2O(g) + N2(g)
2H2O(g) + N2(g)
memberikan data sebagai berikut:
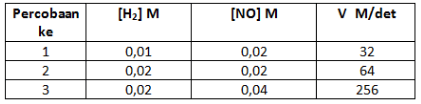
Harga tetapan laju reaksi dari reaksi tersebut adalah…
- 4 × 108
- 8 × 105
- 8 × 106
- 16 × 105
- 16 × 104
Kunci : C
Pembahasan :
Menentukan orde [NO] menggunakan persamaan 2 dan 3
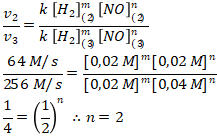
Menentukan orde [H2] menggunakan persamaan 1 dan 2
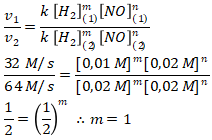
Maka persamaan laju reaksinya 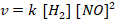
Mencari nilai tetapan laju reaksi (k) menggunakan percobaan 1.
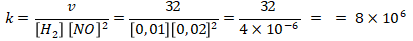

Topik : Redoks dan Elektrokimia
Subtopik : Sel Volta
9. Diketahui potensial standar beberapa sel volta sebagai berikut:
P | P2+ || Q2+ | Q E0 = 2,46 V
R | R2+ || S2+ | S E0 = 1,1 V
R | R2+ || Q2+ | Q E0 = 1,56 V
Potensial standar sel P | P2+ || S2+ | S adalah…
- 1,1 V
- 2,00 V
- 2,66 V
- 3,56 V
- 4,02 V
Kunci : B
Pembahasan :
P | P2+ || Q2+ | Q Eo = 2,46 V
R | R2+ || S2+ | S Eo = 1,1 V
R | R2+ || Q2+ | Q Eo = 1,56 V (perlu dibalik untuk mengeliminasi R)
Reaksi yang dibalik memiliki potensial sel dengan nilai berlawanan, sehingga:
P | P2+ || Q2+ | Q Eo = 2,46 V
R | R2+|| S2+ | S Eo = 1,1 V
Q | Q2+ || R2+ | R Eo = -1,56 V +
P | P2+ || S2+ | S Eo = 2,00 V

Topik : Kesetimbangan Kimia
Subtopik : Konstanta Kesetimbangan Tekanan (Kp)
10. Dalam wadah 2 liter, gas H2dan gas I2 bereaksi membentuk gas HI menurut persamaan reaksi:
H2(g) + I2(g) ![]() 2HI(g)
2HI(g)
Jika pada kesetimbangan reaksi terdapat 0,1 mol H2, 0,2 mol I2 dan 0,5 mol HI, dengan tekanan total sebesar 5 atm, maka nilai Kp reaksi tersebut adalah…
- 7,50
- 12,5
- 25,2
- 32,5
- 50,0
Kunci : B
Pembahasan :
Diketahui: volume = 2 liter; mol total = 0,1 mol + 0,2 mol + 0,5 mol = 0,8 mol
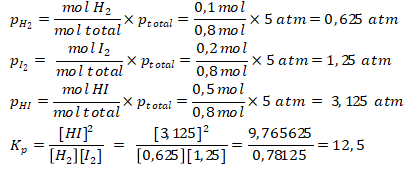

Topik : Stoikiometri
Subtopik : Persamaan Kimia; Perhitungan Kimia dalam Suatu Persamaan Reaksi
11. Suatu campuran yang hanya mengandung gas metana dan etana dibakar sempurna sehingga dihasilkan 220 gram CO2. Jika massa campuran yang dibakar adalah 76 gram, maka massa gas etana di dalam campuran gas tersebut (Ar C= 12 H = 1 O = 16) adalah…
- 16 gram
- 30 gram
- 32 gram
- 44 gram
- 60 gram
Kunci : E
Pembahasan :
Metana = CH4 (Mr = 16) Massa etana = x gram (sebagai komponen yang ditanya)
Etana = C2H6 (Mr = 30) Massa metana = (76 – x) gram
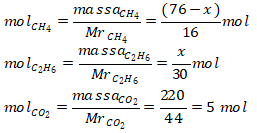
Reaksi pembakaran etana:
C2H6 + O2 → 2CO2 + 3H2O
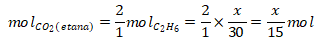
Reaksi pembakaran metana:
CH4 + 2O2 → CO2 + 2H2O
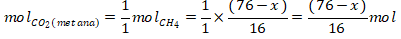
Mol CO2 total = 5 mol
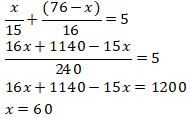

Topik : Kesetimbangan Kimia
Subtopik : Pergeseran Kesetimbangan dan Faktor yang Mempengaruhi…
12. Di bawah ini adalah produksi NH3dalam reaksi:
N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = -92,2 kJ
2NH3(g) ΔH = -92,2 kJ
Jika diketahui pada suhu 25 ℃ nilai Kc = 3,5 × 108, maka pernyataan berikut ini yang benar adalah…
- jika suhu turun, produksi meningkat
- ditambah katalis, produksi menurun
- jika volume turun, produksi menurun
- proses produksinya disebut dengan proses Kontak
- pengurangan konsentrasi N2, produksi meningkat
Kunci : A
Pembahasan :
Produksi NH3 disebut dengan proses Haber-Bosch dengan reaksi
N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = -92,2 kJ (reaksi eksoterm)
2NH3(g) ΔH = -92,2 kJ (reaksi eksoterm)
Maka, pernyataan yang tepat yaitu:
- jika suhu turun, akan bergeser ke eksoterm maka produksi meningkat.
- ditambah katalis, reaksi akan semakin cepat, tidak berpengaruh pada hasil produksi.
- jika volume turun, akan bergeser ke koefisien kecil maka produksi akan meningkat.
- pengurangan konsentrasi N2, akan bergeser ke arah reaktan,jadi produksi menurun.

Topik : Sifat Koligatif Larutan
Subtopik : Kenaikan Titik Didih
13. Struktur molekul PVC dapat dinyatakan (–CH2 –CHCl–)n. Larutan yang mengandung 12,5 gram bahan tersebut dalam 500 gram benzena mendidih pada suhu 80,11℃. Jika harga Kb 2,5 ℃/molal dan titik didih benzena 80,10 ℃, maka harga n (Ar H = 1, C = 12, Cl = 35,5) adalah…
- 50
- 100
- 500
- 1000
- 1500
Kunci : B
Pembahasan :
Diketahui:
massa PVC (terlarut) = 12,5 gram; Tb = 80,11 ℃; Kb = 2,5 ℃/molal
massa benzena (pelarut) = 500 gram; ΔTb = 80,11 ℃ – 80,10 ℃ = 0,01 ℃
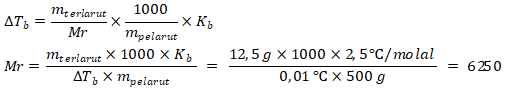
(Rumus Empiris)n = Rumus Molekul
(Mr Empiris)n = Mr Molekul
(62,5)n = 6250 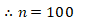

Topik : Termokimia
Subtopik : Penentuan Perubahan Entalpi
14. Diketahui energi rata-rata sebagai berikut:
C – H = 414 kJ/mol H – Cl = 432 kJ/mol
Cl – Cl = 244 kJ/mol C – Cl = 326 kJ/mol
Perubahan entalpi untuk 3,2 gram metana pada reaksi:
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g) adalah … kJ. (Ar C = 12, H = 1)
- -20
- +20
- -80
- +100
- -100
Kunci : A
Pembahasan :
Persamaan reaksi:

ΔH = ∑H reaktan – ∑H produk
ΔH = 658 – 758 = -100 kJ/mol
Maka untuk 3,2 gram metana dilepaskan kalor sebesar 100 kJ/mol.
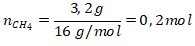
ΔHr = 0,2 mol × -100 kJ/mol = -20 kJ

Topik : Termokimia
Subtopik : Penentuan Perubahan Entalpi
15. Etanol, disebut juga etil alkohol, memiliki rumus molekul C2H5OH adalah sejenis cairan yang mudah menguap dan mudah terbakar sehingga etanol dapat digunakan sebagai bahan bakar. Jika spiritus dianggap hanya mengandung etanol, berapa gram spiritus yang harus dibakar untuk menaikkan suhu 100 gram air dari 20℃ menjadi 50 ℃? Diketahui:
∆Hof H2O(g) = -240 kJ/mol
∆Hof CO2(g) = -394 kJ/mol
∆Hof C2H5OH = -277 kJ/mol
kalor jenis air = 4,2 J/gK
Ar C = 12, H = 1, O = 16
- 0,235 gram
- 0,47 gram
- 0,94 gram
- 6,3 gram
- 12,6 gram
Kunci : B
Pembahasan :
Mr etanol = 46 g/mol; ∆T = 50 ℃ – 20 ℃ = 30 ℃ = 30 K
Reaksi pembakaran etanol adalah: C2H5OH + 3O2 → 2CO2 + 3H2O
∆H = ![]() produk –
produk –![]() reaktan
reaktan
= (2×(-394) + 3×(-240)) – (–277 + 0)
= –1231 kJ/mol
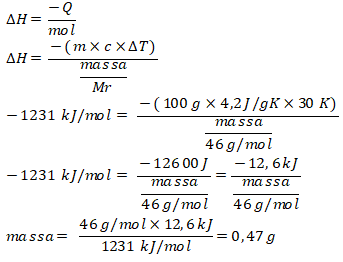

Nah, itulah beberapa kumpulan latihan soal UTBK Kimia yang bisa kamu jadikan bahan belajarmu untuk persiapan SBMPTN 2022 mendatang. Mau dapat persiapan ekstra untuk UTBK? Kamu bisa bergabung di dalam #PelatnasUTBK! Dapatkan program harian yang dirancang khusus oleh tim Ruangguru untuk membantu persiapanmu. Tidak hanya materi pelajaran, #PelatnasUTBK juga akan memberikan pelatihan kesiapan mental, sehingga fisik dan mentalmu lebih siap dan optimal. Daftar dengan klik di bawah ini ya.
Yuk, berlatih lebih banyak soal lagi dengan ikut tryout UTBK di ruanguji. Psst, soal-soal dan sistem penilaiannya sama seperti UTBK aslinya, lho! Yakin nggak mau cobain?
![[IDN] Blog Grup Pelatnas UTBK Ruangguru](https://cdn-web.ruangguru.com/landing-pages/assets/cta/08dbc3c1-522d-4ce9-99ad-730dc9c4dace.png)


















