Kovalen Rangkap serta Penyimpangan Kaidah Oktet | Kimia Kelas 10

Hai RG Squad, kalian tentu sudah membaca artikel tentang ikatan kovalen Struktur Lewis ‘kan? Pada artikel ini juga akan membahas tentang kaitannya pada Struktur Lewis. Nah di artikel ini, kalian bisa dengan seksama memahami tentang kovalen rangkap dua, kovalen rangkap 3, dan juga penyimpangan kaidah oktet. Dibaca dengan seksama ya!
1. Ikatan Kovalen Rangkap Dua
Ikatan ini dibentuk oleh atom-atom nonlogam yang menyumbangkan dua elektron tidak berpasangan untuk berikatan sehingga memenuhi kaidah. Berikut ini beberapa contoh yang memliki kovalen berangkap dua:
a. Struktur Lewis Molekul O2
Dalam atom O terdapat dua elektron yang tidak berpasangan. Jika dua atom O saling berikatan dan setiap atom menyumbangkan kedua elektron tidak berpasangan yang dimilikinya, terbentuklah molekul O2 yang memiliki Struktur Lewis sebagai berikut.
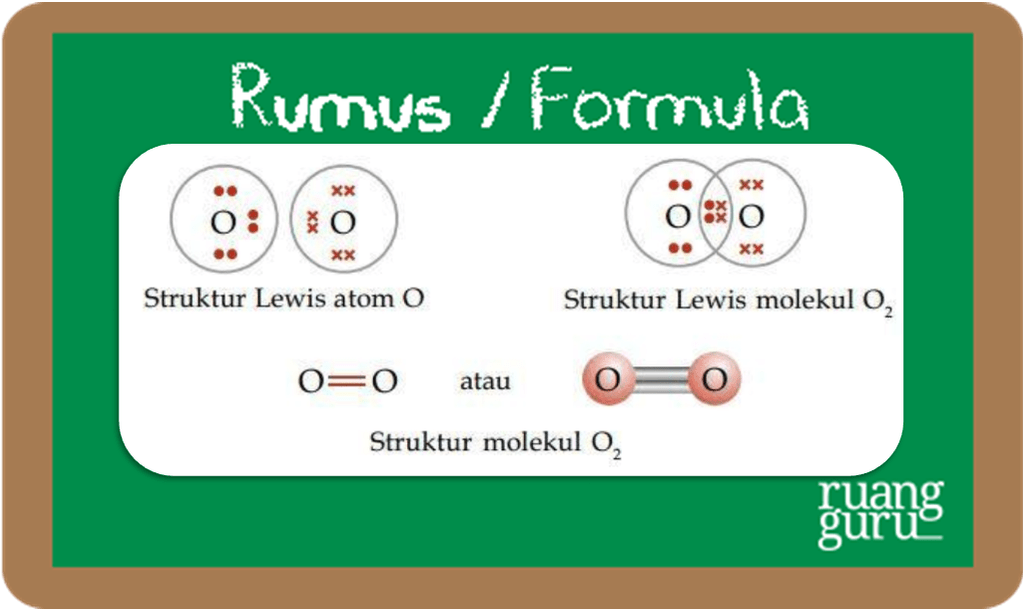
Gambar Struktur Lewis O2
Jadi, molekul O2 memiliki satu ikatan rangkap dua. Perhatikan bahwa setiap atom O (yang dilingkari) memiliki delapan elektron.
b. Struktur Lewis Molekul CO2
Dalam atom C terdapat empat elektron tidak berpasangan,sedangkan setiap atom O memiliki dua elektron tidak berpasangan. Jika atom C berikatan dengan atom O, satu atom C memerlukan dua atom O sehingga setiap elektron bebas menjadi berpasangan membentuk ikatan rangkap dua.
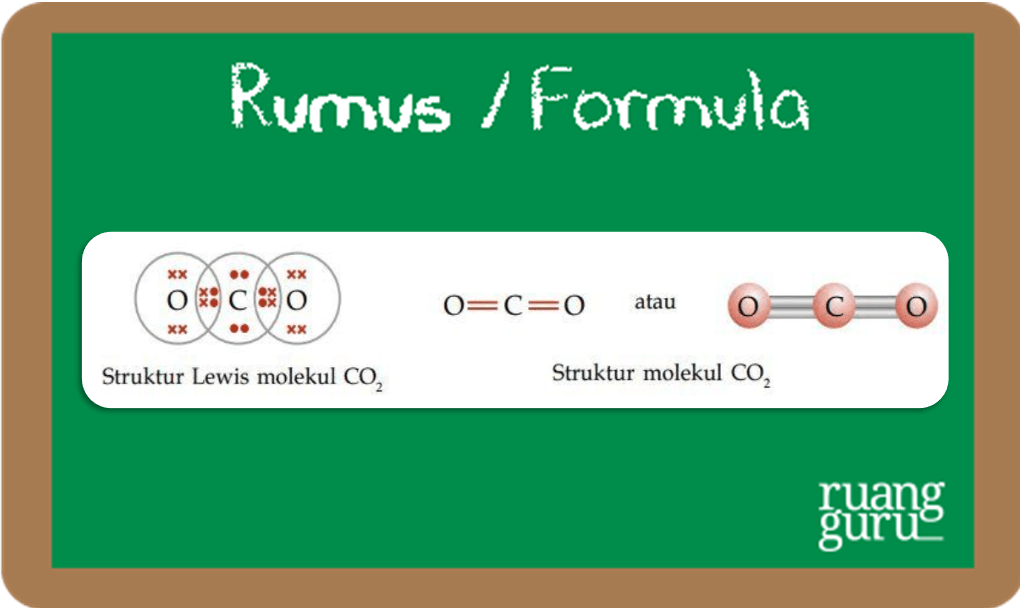
Gambar Struktur lewis CO2
Jadi, molekul CO2 memiliki dua ikatan rangkap dua.
2. Ikatan Kovalen Rangkap Tiga
Ikatan ini dibentuk oleh atom-atom nonlogam yang meyumbangkan tiga elektron, tidak berpasangan untuk berikatan, sehingga memenuhi kaidah. Contohnya ialah senyawa N2. Dalam struktur Lewis molekul N2, atom N memiliki tiga elektron yang tidak berpasangan. Jika dua atom N berikatan, setiap elektron yang tidak berpasangan saling berikatan dan membentuk struktur lewis sebagai berikut.
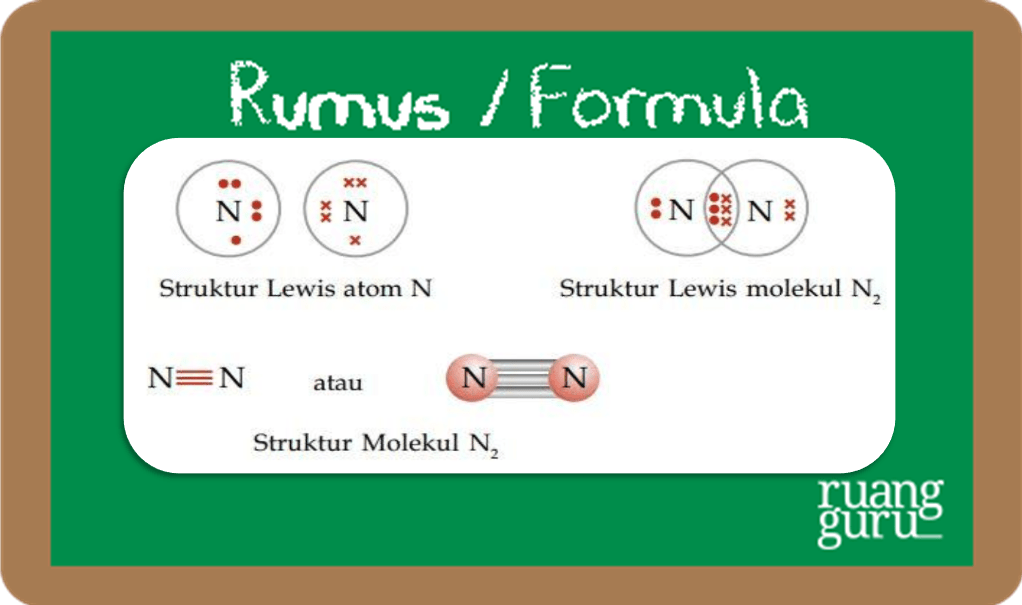
Gambar Struktur Lewis N2
Jadi, dalam molekul N2 terdapat ikatan rangkap tiga.
3. Penyimpangan Kaidah Oktet
Kaidah oktet sangat bermanfaat untuk meramalkan senyawa yang akan dibentuk oleh unsur-unsur. Namun, ada pengecualian atas kaidah ini. Beberapa senyawa bersifat stabil meskipun tidak memenuhi kaidah, misalnya BF3. Atom 5B memiliki konfigurasi elektron 5B: 2,3. Atom B ini memiliki tiga elektron valensi. Distribusi elektron valensi atom B dan pembentukan ikatan pada BF3 sebagai berikut.
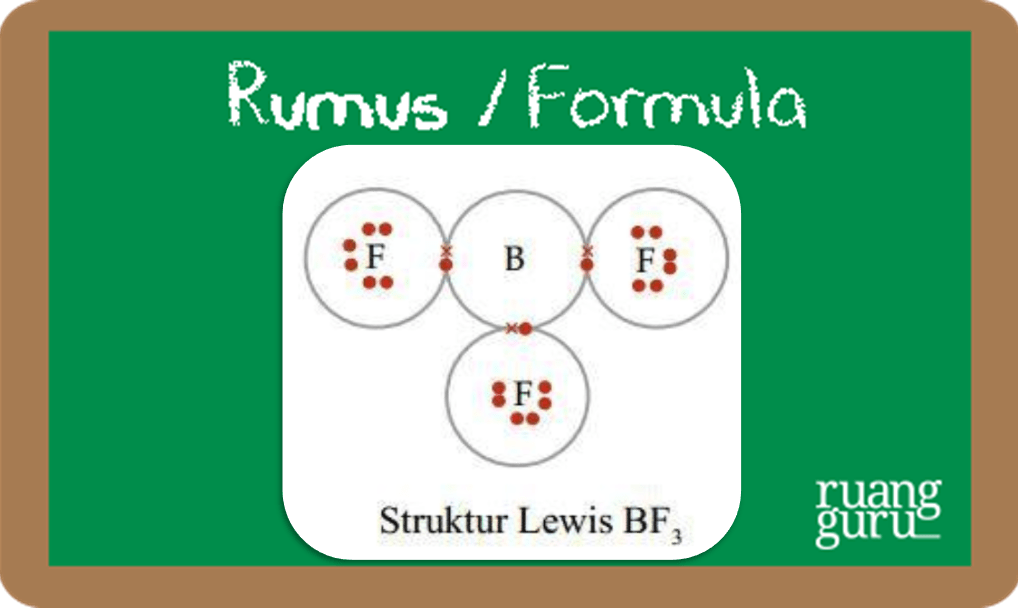
Gambar Struktur Lewis BF3
Elektron yang dilingkari pada atom B hanya berjumlah enam sehingga kurang dua elektron untuk memenuhi kaidah. Jadi, senyawa BF3 tidak mengikuti kaidah oktet. Hal ini juga berlaku untuk senyawa Boron lainnya, seperti BH3 dan BCl3.
Bagaimana struktur Lewis PCl5? Konfigurasi elektron atom 15P: 2, 8, 5. Atom P memiliki elektron valensi lima. Oleh karena dalam senyawa PCl5 satu atom P mengikat lima atom Cl, elektron valensi pada atom P harus terdistribusi pada lima posisi. Setiap atom Cl menerima satu elektron dari atom P.

Gambar Struktur Lewis PCl5
Pada atom P yang dilingkari terdapat sepuluh elektron (kelebihan dua elektron) untuk memenuhi kaidah oktet. Jadi, senyawa PCl5 juga tidak memenuhinya.
Bagaimana RG Squad? Sudah paham kan? Jika kalian ingin tahu lebih banyak tentang materi fisika dan berdiskusi langsung ke tutor yang sudah berpengalaman, daftar sekarang yuk di Ruangguru digitalbootcamp.




















