Konsep Struktur Lewis dalam Ikatan Kovalen & Cara Menggambarnya | Kimia Kelas 10
Yuk, cari tahu tentang konsep struktur lewis dalam ikatan kovalen, beserta cara menggambarnya! Baca artikel ini sampai selesai, ya!
—
Hai, teman-teman! Kamu tahu nggak sih, ternyata ada lho ikatan kimia antar atom yang terjadi melalui sharing elektron. Wah, gimana tuh, maksudnya?
Jadi, ada atom-atom yang memiliki kecenderungan untuk menerima elektron, artinya, ketika saling berikatan, mereka akan berbagi elektron agar stabil. Nah, proses ini dapat dipelajari melalui teori Lewis atau teori dot-cross.
Tujuan dari dilakukannya berbagi elektron atau sharing elektron ini adalah agar atom-atom tersebut bisa stabil, yaitu memiliki konfigurasi elektron sama dengan gas mulia. Ada dua jenis kestabilan gas mulia yang perlu kamu tahu, yakni duplet dan oktet.
Pertama adalah kestabilan duplet, di mana konfigurasi elektronnya sama dengan helium yaitu 2 elektron valensi. Kestabilan ini terjadi pada atom hidrogen, lithium, dan helium sendiri.
Kedua adalah kestabilan oktet atau kaidah oktet, di mana konfigurasi elektronnya sama dengan 8 elektron valensi. Kestabilan ini adalah kestabilan yang terjadi secara umum pada atom-atom sistem periodik unsur, sehingga mayoritas atom akan berusaha memiliki elektron valensi sama dengan 8. Salah satu caranya adalah dengan melakukan sharing elektron tadi.
Menariknya, sharing elektron atau pemakaian pasangan elektron bersama ini terjadi pada atom-atom nonlogam, lho! Ikatan antaratom nonlogam yang terjadi melalui pemakaian pasangan elektron bersama disebut ikatan kovalen. Untuk bisa melihat bagaimana ikatan kovalen terjadi kita harus memahami terlebih dahulu konsep dari struktur Lewis. Oke, kita pahami secara seksama, yuk!
Baca Juga: Bentuk Molekul Berdasarkan Teori Domain Elektron & Teori Hibridisasi
Pengertian Struktur Lewis
Struktur Lewis adalah penggambaran distribusi elektron dalam suatu struktur molekul dengan menggunakan tanda elektron. Tanda elektron yang digunakan, biasanya berupa tanda titik (.) dan tanda silang (x), sehingga teori Lewis ini sering juga disebut sebagai teori dot-cross Lewis.
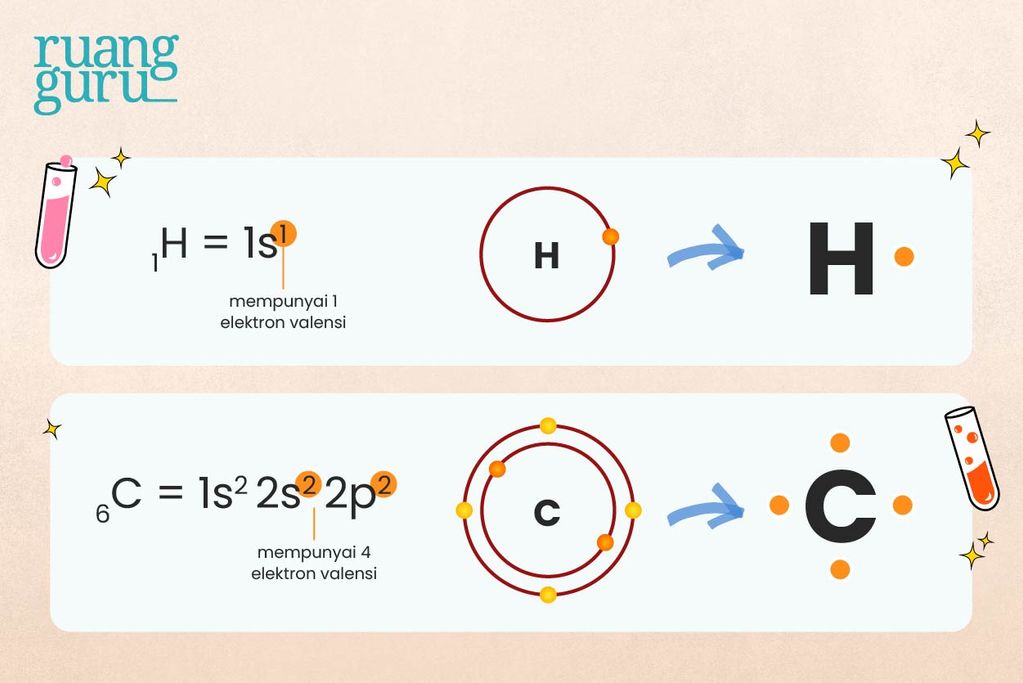
Nah, sekarang coba deh, perhatikan contoh pembentukan ikatan kovalen tunggal pada senyawa CH4 berikut ini. Konfigurasi elektron atom 6C: 2, 4. Jadi, atom C memiliki 4 elektron valensi, sedangkan atom H konfigurasinya hanya 1 saja, atau memiliki 1 elektron valensi.
Ketika atom karbon (C) berikatan dengan atom hidrogen (H) makan setiap atom C mampu mengikat 4 atom H membentuk CH4. Setiap elektron dari atom H akan berikatan dengan satu elektron dari atom C, sehingga antara C dengan H terdapat satu pasang elektron ikatan (PEI).
Dalam atom C terdapat empat elektron yang tidak berpasangan sehingga untuk memenuhi kaidah oktet diperlukan empat atom H.
Setelah berikatan akan didapatkan 4 pasang elektron ikatan bersama antara atom C dan H, sehingga didapatkan struktur Lewis antara C dan H menjadi seperti berikut:
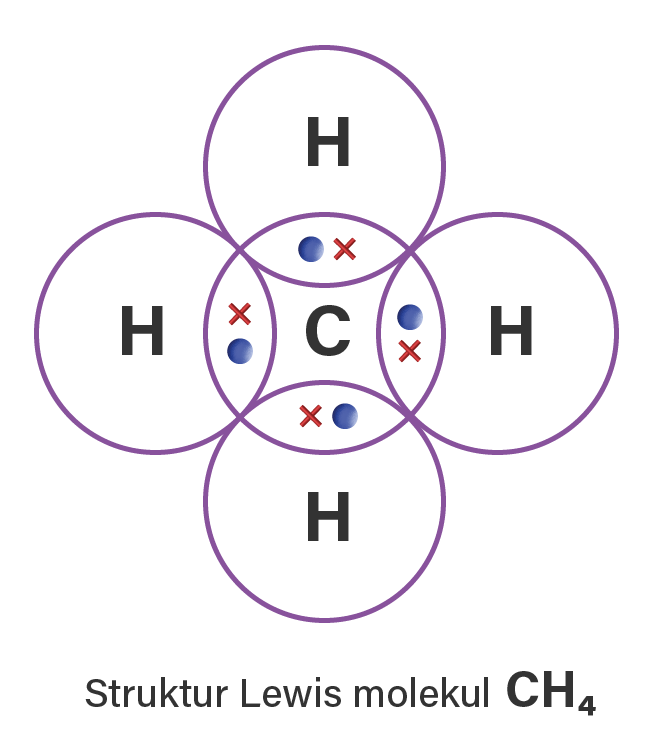
Lalu bagaimana mengetahui kestabilan aton C dan H setelah berpasangan?
Perhatikan pada setiap atom H yang dilingkari, terdapat dua elektron (duplet) dan pada atom C yang dilingkari terdapat delapan elektron (oktet). Tanda titik (.) dan tanda silang (x) hanya notasi yang digunakan untuk membedakan elektron yang berasal dari atom C dengan elektron yang berasal dari atom H.
Kemudian, satu pasang elektron ikatan (PEI) dapat diganti dengan sebuah garis atau lengan ikatan. Dalam CH4 terdapat empat pasang elektron ikatan, sehingga terdapat 4 garis atau lengan ikatan, bisa dilihat pada gambar berikut:
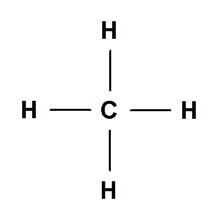
Struktur Lewis CH4 menggunakan garis
Ikatan kovalen yang terbentuk pada senyawa CH4, dinamakan ikatan kovalen tunggal, karena terdapat empat ruas garis tunggal antara atom C dan H. Agar lebih memahami pembentukan ikatan kovalen tunggal, yuk pelajari ulasan berikut ini!
Baca Juga: Cara Mencari Rumus Molekul Unsur dan Senyawa
Cara Menggambar Struktur Lewis
Untuk menggambar struktur lewis, kamu bisa mengikuti langkah-langkah di bawah ini:
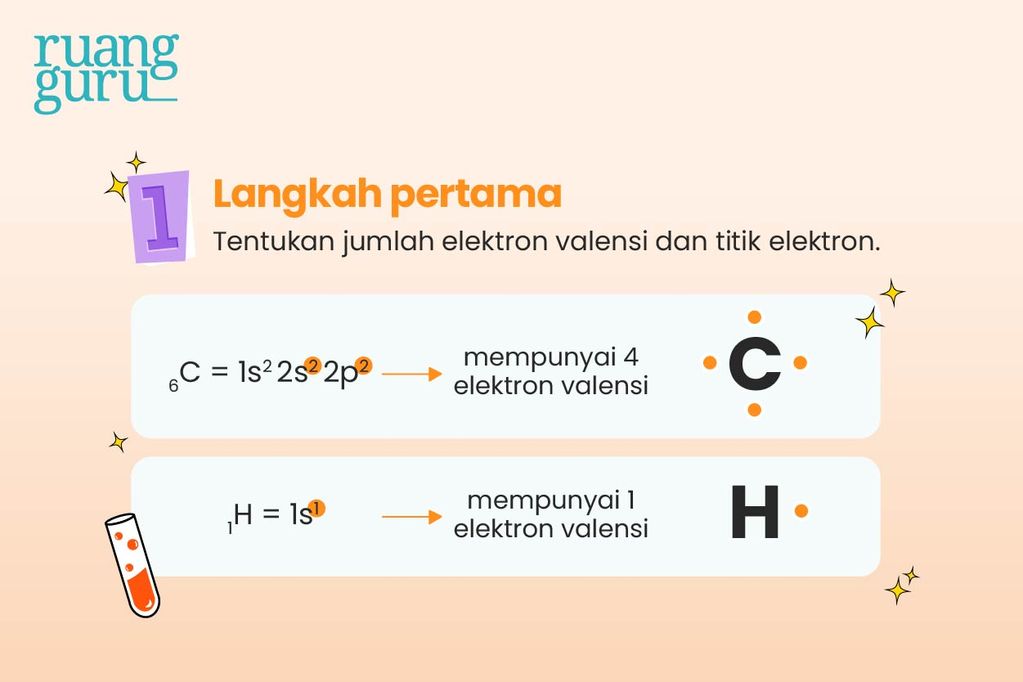
1. Tentukan jumlah elektron valensi dan kebutuhan elektron untuk stabil
Misalnya, kita mau menggambar struktur lewis CH4, maka tentukan dulu jumlah elektron valensi dari masing-masing penyusun molekul CH4, yakni atom karbon (C) dan atom hidrogen (H).
Atom C dengan konfigurasi elektron 2 dan 4, memiliki 4 elektron valensi, sehingga untuk mencapai oktet (elektron valensi sama dengan 8) atom C membutuhkan 4 elektron lagi. Agar mendapatkan 4 elektron, atom C harus memasangkan 4 elektronnya dengan elektron dari atom H.
Sedangkan atom H dengan 1 elektron valensi, membutuhkan 1 elektron agar mencapai kestabilan duplet, sehingga tiap atom H akan memasangkan 1 elektron yang dimilikinya.
2. Tentukan atom pusat
Cara menentukan atom pusat adalah dengan mencari atom yang jumlahnya paling sedikit dalam molekul tersebut. Molekul yang mau kita gambar struktur lewisnya adalah CH4, berarti ada satu atom karbon dan empat atom hidrogen.
Berarti atom pusatnya adalah atom karbon alias atom C yang jumlahnya paling sedikit. Kemudian, gambarkan satu atom C di tengah dan empat atom H mengelilingi atom C.
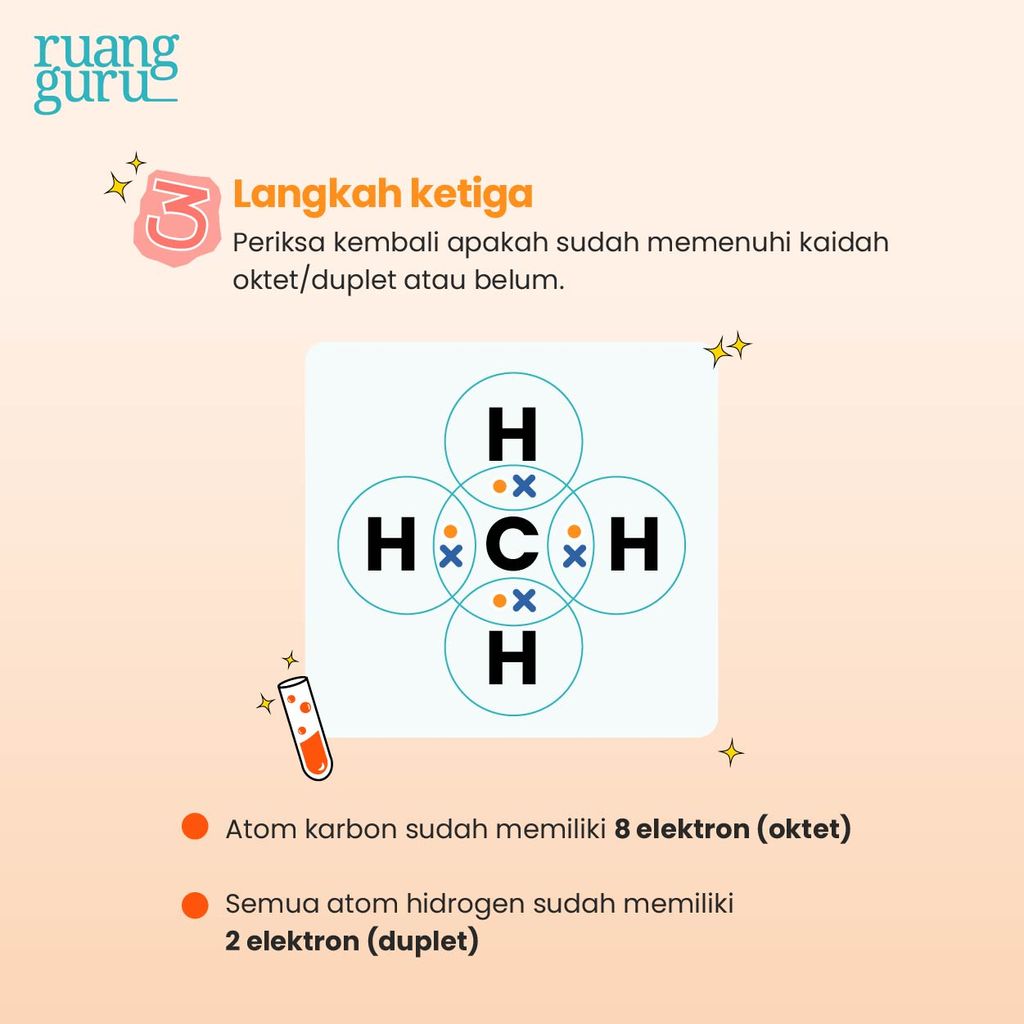
3. Memasangkan elektron dan periksa kembali apakah sudah memenuhi kestabilan
Setelah menggambar satu atom C di tengah dengan dikelilingi empat atom H, lalu pasangkan 1 elektron atom C dengan 1 elektron atom H. Karena ada 4 atom H, maka terdapat 4 pasang elektron ikatan. Kemudian lihat dan periksa apakah sudah memenuhi kaidah oktet/duplet atau belum.
Dikatakan memenuhi kaidah oktet apabila atom tersebut sudah memiliki delapan elektron. Sementara itu, dikatakan memenuhi kaidah duplet apabila atom tersebut sudah memiliki dua elektron.
Karena atom C telah memiliki delapan elektron dan keempat atom H telah memiliki masing-masing dua elektron, maka gambar kita sudah memenuhi baik kaidah oktet maupun duplet. Kalau sudah begini, tandanya gambar kita sudah benar, guys! Selesai, deh!
Contoh Struktur Lewis
Berikut adalah beberapa contoh struktur Lewis molekul beserta gambarnya:
1. Struktur Lewis Molekul NH3
Atom 7N memiliki konfigurasi elektron sebagai berikut 7N: 2, 5. Jadi,atom N memiliki elektron valensi sebanyak 5 elektron, dan kamu bisa gambar dengan titik seperti berikut:
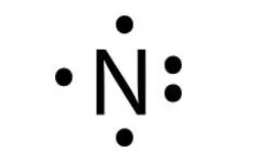
Struktur Lewis N
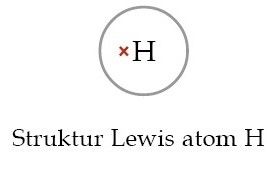
Sedangkan atom H dengan 1 elektron valensi, bisa kamu gambar dengan 1 tanda silang seperti berikut:
Atom 7N memiliki tiga elektron valensi tidak berpasangan sehingga untuk memenuhi kaidah oktet diperlukan tiga elektron dari atom H. Atom N akan berbagi 3 elektron dan 3 atom H akan berbagi masing-masing 1 elektron.
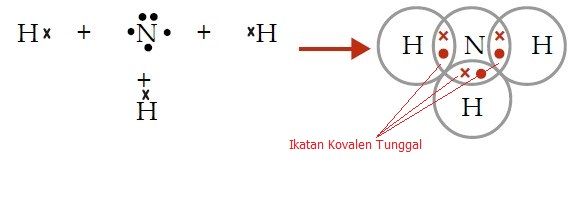
Struktur Lewis NH3
Dalam molekul NH3 terdapat sepasang elektron yang tidak digunakan (elektron bebas) sehingga disebut Pasangan Elektron Bebas (PEB). Tiga pasang elektron yang digunakan bersama oleh atom N dan atom H disebut Pasangan Elektron Ikatan (PEI).
Baca Juga: Rumus Massa Atom Relatif (Ar) dan Cara Menghitungnya
2. Struktur Lewis Molekul H2O
Atom 8O memiliki konfigurasi elektron 8O:2, 6. Jadi, atom O memiliki elektron valensi 6 dengan distribusi sebagai berikut.

Struktur Lewis O
Pada atom O terdapat dua elektron tidak berpasangan sehingga diperlukan dua elektron lain untuk memenuhi kaidah oktet.

Struktur Lewis H2O
Dalam H2O terdapat dua PEB dan dua PEI. Lalu, bagaimana struktur lewis molekul yang terbentuk dari atom sejenis, seperti Cl2?
3. Struktur Lewis Molekul Cl2
Atom Cl dengan 7 elektron valensi, memiliki satu elektron yang tidak berpasangan sehingga pada pembentukan molekul Cl2, masing-masing atom Cl akan memasangkan 1 elektron yang tidak berpasangan, sehingga setelah berpasangan akan didapatkan 8 elektron valensi pada setiap atom Cl dan telah memenuhi kaidah oktet.
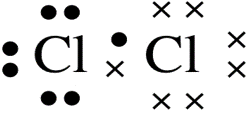
Struktur Lewis Cl2
Itu tadi pembahasan tentang konsep struktur lewis dalam ikatan kovalen. Masih kurang paham? Lanjut belajar bersama guru privat di Ruangguru Privat!
Belajar nggak cuma menyenangkan, tapi kamu juga bakal diajari konsepnya sampai paham! Para pengajar di Ruangguru Privat juga sudah terstandarisasi kualitasnya, loh. Kamu juga bisa pilih nih, mau diajarkan secara langsung (offline) atau daring (online). Fleksibel, kan? Untuk info lebih lanjut, cuss klik link berikut!
Sumber Gambar:
Gambar ‘Struktur Lewis CH4’, [Daring]. Tautan: https://roboguru-forum-cdn.ruangguru.com/d0c3b3d6-7a7a-4422-80cb-816313ef1263.png (Diakses: 26 Oktober 2022)
Gambar ‘Struktur Lewis CH4 Garis’, [Daring]. Tautan: https://www.geogebra.org/resource/xn5cwkd3/OYkL255rRZwSzcvK/material-xn5cwkd3.png (Diakses: 26 Oktober 2022)
Gambar ‘Struktur Lewis N’, [Daring]. Tautan: https://qph.cf2.quoracdn.net/main-qimg-70d9cb1cc4e48c3d91d0e64c949a0d4c (Diakses: 26 Oktober 2022)
Gambar ‘Struktur Lewis H’, [Daring]. Tautan:https://www.nafiun.com/2013/03/contoh-ikatan-kovalen-tunggal-proses-pembentukan-pengertian-soal-kunci-jawaban-senyawa-unsur-kimia.html (Diakses: 26 Oktober 2022)
Gambar ‘Struktur Lewis NH3’, [Daring]. Tautan:https://materikimia.com/wp-content/uploads/2020/01/Ikatan-Kovalen-Tunggal-NH3.jpg (Diakses: 26 Oktober 2022)
Gambar ‘Struktur Lewis O’, [Daring]. Tautan: https://es-static.z-dn.net/files/dda/189d6e397ee29a9cde70d6a0d14b6c69.png (Diakses: 26 Oktober 2022)
Gambar ‘Struktur Lewis Cl2’, [Daring]. Tautan: https://imgix2.ruangguru.com/assets/miscellaneous/png_oczc1n_3202.png (Diakses: 26 Oktober 2022)




















